Hvordan navngi kjemiske forbindelser
Forfatter:
Laura McKinney
Opprettelsesdato:
2 April 2021
Oppdater Dato:
26 Juni 2024

Innhold
- stadier
- Metode 1 Nomenklatur av ioniske forbindelser
- Metode 2 Nomenklatur av polyatomiske forbindelser
- Metode 3 Nomenklatur av kovalente forbindelser
For å lykkes innen kjemi krever du å vite hvordan du kan navngi de grunnleggende kjemiske forbindelsene. Denne guiden gir deg grunnleggende regler om navneprosessen for kjemiske forbindelser og hvordan du tilordner navn til forbindelser som ikke er kjent for deg.
stadier
Metode 1 Nomenklatur av ioniske forbindelser
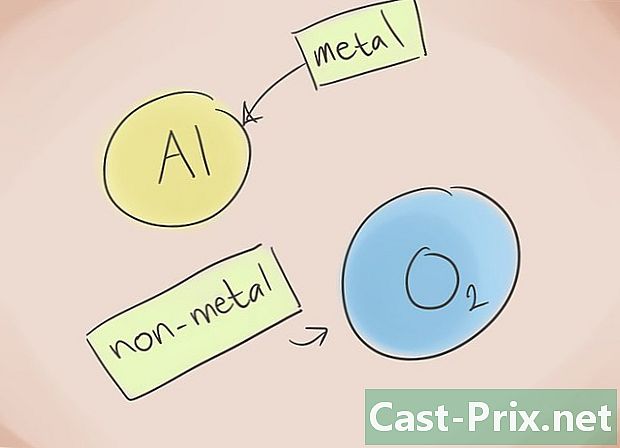
- Hva er en ionisk forbindelse? Ioniske forbindelser består av et metall og et ikke-metall. Henvis deretter til det periodiske elementet for å vite hvilke kategorier som hører til elementene som er tilstede i forbindelsen.
-

Form navnet. Ingenting er enklere enn å navngi en ionisk forbindelse av to elementer. Den første delen av navnet på forbindelsen tilsvarer faktisk navnet på det ikke-metalliske elementet som har endelsen "ure", mens den andre tilsvarer navnet på metallelementet. Det er unntak: oksid, fosfid, nitrid, sulfid.- Eksempel: Al2O3. al2 = Aluminium; O3 = Oksygen. Så navnet på forbindelsen vil være "aluminiumoksyd".
-
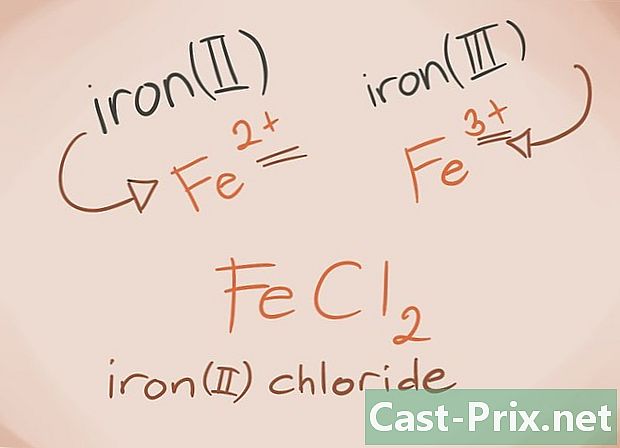
Kjenne overgangsmetallene. Overgangsmetallene er de som finnes i D- og F-blokkene i det periodiske systemet. I forbindelsens navn er ladningen på disse metallene skrevet med romertall. Dette er fordi overgangsmetaller kan bære mer belastning og danne mer av en forbindelse.- Eksempel: FeCl2 og FeCl3. Fe = jern; cl2 = -2 klorid; cl3 = Klorid -3. Som navn vil det være jernklorid (II) og jernklorid (III).
Metode 2 Nomenklatur av polyatomiske forbindelser
-

Du må forstå hva en polyatomisk forbindelse er. Polyatomiske forbindelser er forbindelser dannet av en gruppe datomer assosiert med hverandre; hele gruppen som har en kostnad er positiv eller negativ. Det er da tre grunnleggende handlinger som du kan utføre på polyatomiske forbindelser:- Du kan tilsette et hydrogen til den første delen av forbindelsen. Ordet "hydrogen" er faktisk lagt til i begynnelsen av navnet på forbindelsen. Dette vil redusere verdien av den negative ladningen med en. For eksempel "karbonat" CO3 blir "hydrogenkarbonat" HCO3.

- Du kan også fjerne oksygen fra forbindelsen. Lasten blir ikke endret, men "-ate" -suffikset av forbindelsen endres til "-ique". For eksempel transformasjonen av: NO3 i NO2 vi går fra nitrat til nitrat. "

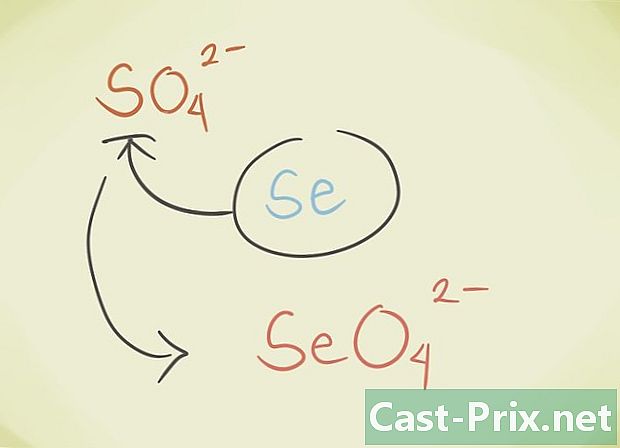
- Du kan erstatte den sentrale latomen til forbindelsen med et annet atom som tilhører den samme periodiske gruppen. For eksempel SO-sulfat4 kan erstattes av Selenate SeO4.
- Du kan tilsette et hydrogen til den første delen av forbindelsen. Ordet "hydrogen" er faktisk lagt til i begynnelsen av navnet på forbindelsen. Dette vil redusere verdien av den negative ladningen med en. For eksempel "karbonat" CO3 blir "hydrogenkarbonat" HCO3.
-

Husk de vanligste diongruppene. Gruppene nedenfor brukes til å danne de fleste polyatomiske forbindelser. Etter den økende rekkefølgen på deres negative ladning, har vi:- hydroksydioner: OH
- nitrationer: NO3
- Hydrogenkarbonationer: HCO3
- permanganationer: MnO4
- karbonationer: CO3
- kromater: CrO4
- dikromationer: Cr2O7
- sulfationer: SÅ4
- sulfittioner: SÅ3
- tiosulfationer: S2O3
- Fosfationer: PO4
- ammoniumioner: NH4
- Form sammensatte navn fra listen over. Dann en navneforening med noen av elementene relatert til gruppen. Hvis elementet er plassert foran den ioniske gruppen, vil elementnavnet ganske enkelt legges til begynnelsen av sammensatte navn.
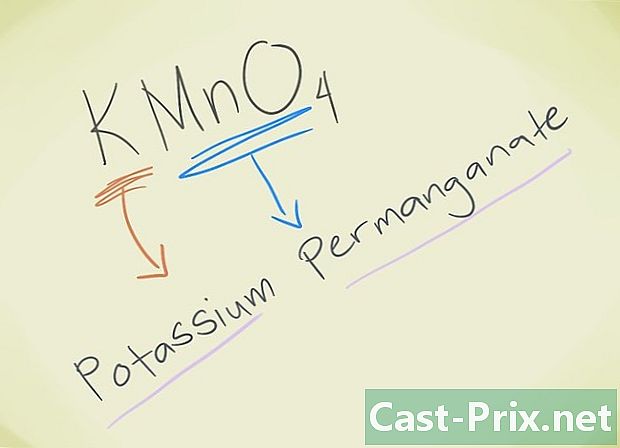
- Eksempel: KMnO4. Du må kunne kjenne den løven MnO4 tilsvarer løvepermanganat. K refererer til kalium. Så forbindelsen din vil bli kalt Permanganat Kalium.
- Eksempel: NaOH. Du vil sannsynligvis ha forstått her at det er OHOH. Na er natrium, så forbindelsen vil bli kalt natriumhydroksyd.

- Eksempel: KMnO4. Du må kunne kjenne den løven MnO4 tilsvarer løvepermanganat. K refererer til kalium. Så forbindelsen din vil bli kalt Permanganat Kalium.
Metode 3 Nomenklatur av kovalente forbindelser
-
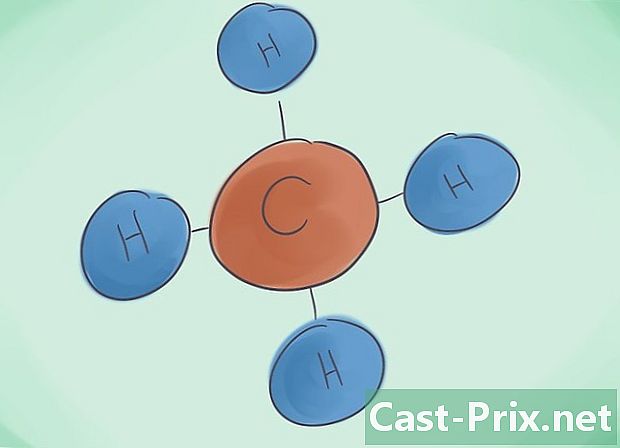
Hva er en kovalent forbindelse? De kovalente forbindelser er resultatet av forbindelsen av minst to ikke-metalliske elementer. Navnet på forbindelsen bestemmes av antall datomer som utgjør det. Det greske prefikset ved siden av dette navnet indikerer antall molekyler som er tilstede i forbindelsen. -
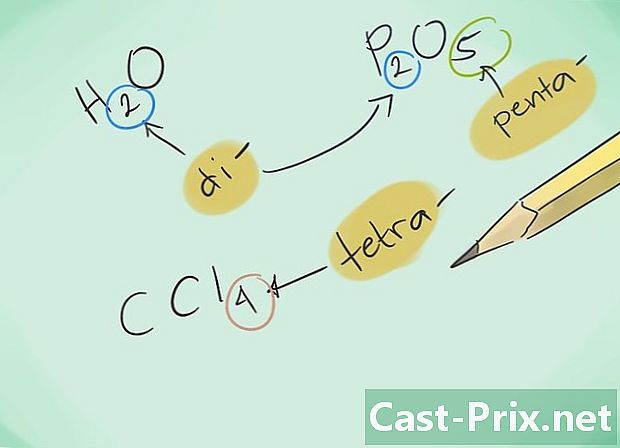
Gjør deg kjent med prefiksene. Husk følgende prefikser for forbindelser med 1 til 8 atomer:- 1 atom - "Mono-"
- 2 atomer - "Di-"
- 3 atomer - "Tri-"
- 4 atomer - "Tetra-"
- 5 atomer - "Penta-"
- 6 atomer - "Hexa-"
- 7 atomer - "Hepta-"
- 8 atomer - "Octa-"
- Nevn deretter forbindelsene. Navngiv den resulterende forbindelsen ved å bruke passende prefikser. Prefikser skal podes på hvert av elementene som utgjør en forbindelse med flere atomer.
- Eksempel: CO vil returnere til karbonmonoksid mens CO2 vil utpeke karbondioksid.
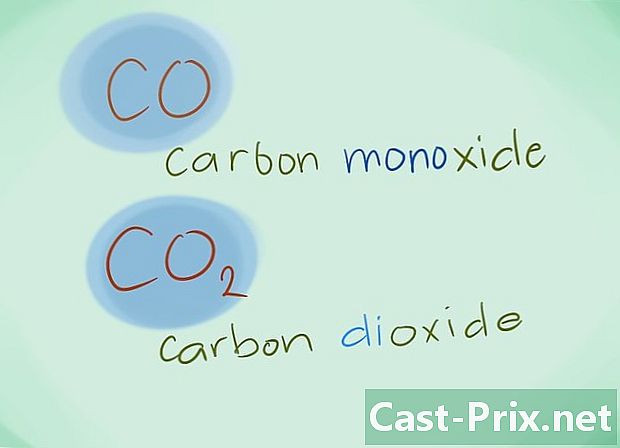
- Eksempel: N2S3 ville tilsvare lystig trisulfid.

- I de fleste tilfeller kan prefikset "mono" utelates; dette, mer enn noen mangel på prefiks, induserer at sistnevnte bør brukes. Dette prefikset blir fortsatt brukt i tilfelle av karbonmonoksid gitt det faktum at denne bruken går tilbake til de første glimrene av kjemi.
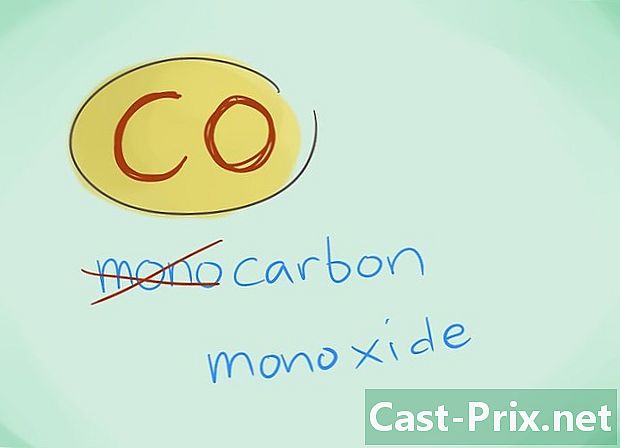
- Eksempel: CO vil returnere til karbonmonoksid mens CO2 vil utpeke karbondioksid.
- Selvfølgelig mistenker du at flere unntak gjelder alle disse reglene; hold for eksempel denne formelen, CaCl2Du forventer å se det kalt "kalsiumdiklorid", som er NEI. Forbindelsen din vil ganske enkelt beholde navnet kalsiumklorid.
- Det skal også bemerkes at alt dette ikke gjelder organisk kjemi.
- De detaljerte reglene her er beregnet på et nybegynnere i kjemi og naturvitenskap. Det er veldig forskjellige regler når du går gjennom det avanserte kjemi-stadiet, som reglene for variabel valens.

